Системы предотвращения пожара
Целью создания систем предотвращения пожаров является исключение условий возникновения пожаров. Исключение условий возникновения пожаров достигается исключением условий образования горючей среды и (или) исключением условий образования в горючей среде (или внесения в нее) источников зажигания.
Определения и термины
Пожар - неконтролируемое горение, причиняющее материальный ущерб, вред жизни и здоровью граждан, интересам общества и государства.
Горение - это физико-химический процесс, сопровождающийся выделением тепла, света и продуктов сгорания (дыма). Приближенно можно описать природу горения как бурно идущее окисление.
Для того, чтобы произошло возгорание, необходимо наличие трех условий (так называемый Пожарный треугольник):
Горючая среда.
Источник зажигания - открытый огонь, химическая реакция, электроток.
Наличие окислителя, например, кислорода воздуха.
Сущность горения заключается в следующем: нагревание источников зажигания горючего материала до начала его теплового разложения. В процессе теплового разложения образуется угарный газ, вода и большое количество тепла. Выделяются также углекислый газ и сажа, которая оседает на окружающем рельефе местности. Время от начала зажигания горючего материала до его воспламенения называется временем воспламенения.
К опасным факторам пожара, воздействующим на людей и имущество, относятся:
1) пламя и искры;
2) тепловой поток;
3) повышенная температура окружающей среды;
4) повышенная концентрация токсичных продуктов горения и термического разложения;
5) пониженная концентрация кислорода;
6) снижение видимости в дыму.
К сопутствующим проявлениям опасных факторов пожара относятся:
1) осколки, части разрушившихся зданий, сооружений, строений, транспортных средств, технологических установок, оборудования, агрегатов, изделий и иного имущества;
2) радиоактивные и токсичные вещества и материалы, попавшие в окружающую среду из разрушенных технологических установок, оборудования, агрегатов, изделий и иного имущества;
3) вынос высокого напряжения на токопроводящие части технологических установок, оборудования, агрегатов, изделий и иного имущества;
4) опасные факторы взрыва, происшедшего вследствие пожара;
5) воздействие огнетушащих веществ.
Из перечисленных выше факторов, воздействующих на людей, чаще всего на пожарах приходится встречаться с дымом и высокой температурой.
Продукты сгорания и разложения, выделяемые на пожаре, являются составными частями дыма.
Основные причины пожаров
Основными причинами пожаров являются:
1. Электротехнические причины:
- Возгорание в результате короткого замыкания , возникающего (в результате повреждения изоляции электропроводов; применение низковольтных проводов «телефонных и т. п.» для силовых и осветительных электросетей; перехода напряжения с электроустановок с высоким напряжением на электроустановки с низким напряжением; схлестывания проводов воздушных линий электропередач; проявление грозовых разрядов молнии).
- Возгорание в результате токовых перегрузок, возникающих в обмотках электродвигателей, аппаратов, в проводах и кабелях при нагрузках превышающих допустимые значения.
- Возгорание в результате образования больших переходных сопротивлений, в местах перехода электрического тока с одной контактной поверхности на другую через площадки их соприкосновения (неплотное соединение токопроводящих элементов, соединения электропроводов «механической» скруткой , соединения электропроводов состоящих из разных металлов – медь и алюминий).
- Возгорание в результате нарушения эксплуатации электронагревательных приборов (установка их на сгораемые поверхности, без использования защитных негорючих теплоизоляционных материалов , не обеспечивая разделки (отступки) от горючих материалов), использование самодельных электронагревательных приборов.
- Возгорание в результате перегорания нити накаливания электролампы с разрушением её колбы, при перенапряжении в электросети, технического брака лампы, в результате чего остатки раскаленной нити накаливания (t-1640 0С) попадая на сгораемые материалы, воспламеняют их (для примера t воспламенения хлопчатобумажной ткани - 2450С, а древесины - 2650С).
2. Неосторожное обращение с огнем (использование открытого огня, тлеющие табачные изделия и др.).
Рассмотрим физико-химические основы процесса горения. Горение - это сложное, быстропротекающее физико-химическое превращение веществ, сопровождающееся выделением тепла и света.
Таким образом, для протекания процесса горения требуется наличие трех факторов: горючего вещества, окислителя и источника зажигания (импульса). Чаще всего окислителем является кислород воздуха, но его роль могут выполнять и некоторые другие вещества: хлор, фтор, бром, йод, оксиды азота и др. Некоторые вещества (например, сжатый ацетилен, хлористый азот, озон) могут взрываться с образованием тепла и пламени. Горение большинства веществ прекращается, когда концентрация кислорода понижается с 21 до 14-18%. Некоторые вещества, например, водород, этилен, ацетилен, могут гореть при содержании кислорода воздуха до 10% и менее.
Источниками зажигания могут служить случайные искры различного происхождения (электрические, возникшие в результате накопления статического электричества, искры от газо- и электросварки и т.д.), нагретые тела, перегрев электрических контактов и др.
Различают полное и неполное горение. Процессы полного горения протекают при избытке кислорода, а продуктами реакции являются вода, диоксиды серы и углерода, т. е. вещества, не способные к дальнейшему окислению.
В зависимости от свойств горючей смеси горение бывает гомогенным и гетерогенным. При гомогенном горении горючее вещество и окислитель имеют одинаковое агрегатное состояние (например, смесь горючего газа и воздуха), а при гетерогенном - вещества при горении имеют границу раздела (например, горение твердых или жидких веществ в контакте с воздухом).
По скорости распространения пламени различают следующие виды горения: дефлаграционное (скорость распространения пламени - десятки метров в секунду), взрывное (сотни метров в секунду) и детонационное (тысячи метров в секунду). Для пожаров характерно дефлаграционное горение.
Принято различать бедные и богатые горючие смеси в зависимости от соотношения горючего и окислителя. Бедные смеси содержат в избытке окислитель, а богатые - горючее.
Процессы возникновения горения следующие:
- - Вспышка - быстрое сгорание горючей смеси, не сопровождающееся образованием сжатых газов;
- - Возгорание - возникновение горения под действием источника зажигания;
- - Воспламенение - возгорание, сопровождающееся появлением пламени;
- - Самовозгорание - явление резкого увеличения скорости экзотермических реакций, приводящее к возникновению горения вещества при отсутствии источника зажигания;
- - Самовоспламенение - самовозгорание, сопровождающееся появлением пламени.
Взрыв - чрезвычайно быстрое химическое (взрывчатое) превращение, сопровождающееся выделением энергии и образованием сжатых газов, способных производить механическую работу.
При пожаре на людей воздействуют следующие опасные факторы: повышенная температура воздуха или отдельных предметов, открытый огонь и искры, токсичные продукты сгорания (например, угарный газ), дым, пониженное содержание кислорода в воздухе, взрывы и др.
Оценим пожарную опасность (пожароопасность) различных веществ и материалов, учитывая их агрегатное состояние (твердое, жидкое или газообразное). Основные показатели пожарной опасности - температура самовоспламенения и концентрационные пределы воспламенения.
Температура самовоспламенения - минимальная температура вещества или материала, при которой происходит резкое увеличение скорости экзотермических реакций, заканчивающееся пламенным горением. Отличие этого процесса от процесса возгорания заключается в том, что при последнем процессе загорается только поверхность вещества или материала, а при самовоспламенении горение происходит во всем объеме. Процесс самовоспламенения происходит только в том случае, если количество теплоты, выделяемое в процессе окисления, превысит ее отдачу в окружающую среду.
Смеси горючих газов, паров и пыли с окислителем способны гореть только при определенном соотношении в них горючего вещества. Минимальную концентрацию горючего вещества, при котором оно способно загораться и распространять пламя, называют нижним концентрационным пределом воспламенения. Наибольшую концентрацию, при которой еще возможно горение, называют верхним концентрационным пределом воспламенения. Область концентрации между этими пределами представляет собой область воспламенения.
Значения нижнего и верхнего пределов воспламенения не являются постоянными, а зависят от мощности источника воспламенения, содержания в горючей смеси инертных компонентов, температуры и давления горючей смеси. Кроме концентрационных различают и температурные пределы (нижний и верхний) воспламенения, под которыми понимают такие температуры вещества или материала, при которых его насыщенные горючие пары образуют в окислительной среде концентрации, равные соответственно нижнему и верхнему концентрационным пределам распространения пламени.
Температура воспламенения - это минимальная температура вещества или материала, при которой они выделяют горючие пары и газы с такой скоростью, что при наличии источника зажигания возникает устойчивое горение. После удаления этого источника вещество продолжает гореть. Таким образом, температура воспламенения характеризует способность вещества к самостоятельному устойчивому горению.
Температура вспышки (t всп) - это минимальная температура горючего вещества, при которой над его поверхностью образуются пары или газы, способные вспыхнуть от источника. Скорость образования горючих газов при вспышке еще недостаточна для возникновения пламени.
Температура вспышки используется для характеристики всех горючих жидкостей по пожарной опасности. По этому показателю все горючие жидкости делятся на два класса: легковоспламеняющиеся (ЛВЖ), к которым относятся жидкости с температурой вспышки до 61°С (бензин, ацетон, этиловый спирт и др.) и горючие (ПК) с температурой вспышки выше 61°С (масло, мазут, формалин и др.).
Температура воспламенения, температура вспышки, а также температурные пределы воспламенения относятся к показателям пожарной опасности. В таблице 1.1 представлены эти показатели для некоторых технических продуктов.
Пыли многих твердых горючих веществ, взвешенные в воздухе, образуют с ним воспламеняющиеся смеси. Минимальную концентрацию пыли в воздухе, при которой происходит ее загорание, называют нижним концентрационным пределом воспламенения пыли. Понятие верхнего концентрационного предела воспламенения для пыли не применяется, так как невозможно создавать очень большие концентрации пыли во взвешенном состоянии.
ГОСТ 12.1.004-76 «ССБТ. Пожарная безопасность. Общие требования» предусматривает следующую классификацию веществ:
НГ - негорючее вещество, т. е. вещество, неспособное к горению в атмосфере воздуха обычного состава;
ТГ - трудногорючее вещество, т. е. вещество, способное гореть под воздействием источника зажигания, но не способное к самостоятельному горению после удаления его;
ГВ - горючее вещество, т. е. вещество, способное самостоятельно гореть после удаления источника зажигания;
ГЖ - горючая жидкость, т. е. жидкость, способная самостоятельно гореть после удаления источника зажигания и имеющая температуру вспышки выше 61 (в закрытом тигле) или 66°С (в открытом тигле);
ЛВЖ -легковоспламеняющаяся жидкость, т. е. жидкость, способная самостоятельно гореть после удаления источника зажигания и имеющая температуру вспышки не выше 61 (в закрытом тигле) или 66°С (в открытом тигле);
ГГ - горючий газ, т. е. газ, способный образовывать с воздухом воспламеняемые и взрывоопасные смеси при температурах не выше 55 °С;
ВВ - взрывоопасное вещество, т. е. вещество, способное к взрыву или детонации без участия кислорода воздуха.
Кроме рассмотренных характеристик пожароопасности веществ и материалов, используется понятие горючести вещества или материала, т. е. их способности к горению. По этому признаку все вещества делятся на горючие (сгораемые), трудногорючие (трудносгораемые) и негорючие (несгораемые).
Горючими называют такие вещества и материалы, которые продолжают гореть и после удаления источника зажигания. Трудносгораемые вещества способны возгораться на воздухе от источника зажигания, но после его удаления самостоятельно гореть не могут. Негорючие вещества и материалы не способны гореть на воздухе. Для количественной характеристики горючести веществ и материалов используют показатель возгораемости В, смотреть формулу 2.1
где Q u - количество теплоты, полученный от источника поджигания;
Q 0 - количество теплоты, выделяемой образцом при горении в процессе испытания.
Если величина В более 0,5, то материалы относят к сгораемым, для трудносгораемых В = 0,1-0,5, а для несгораемых - В менее 0,1.
Горение – сложный физико‑химический, быстро протекающий процесс, который сопровождается выделением значительного количества тепла и ярким свечением.
Горение происходит в результате окисления вещества, способного к горению (горючего), окислителем (кислородом воздуха, хлором).
Виды возгорания: вспышка, воспламенение, самовоспламенение, самовозгорание.
Горение – это комплекс взаимосвязанных химических и физических процессов.
Свойство горения – это способность возникшего очага пламени перемещаться по всей горючей смеси путем передачи тепла из зоны горения в свежую смесь.
Источники зажигания – это искры, пламя, накаленные предметы, трение, удар.
Для возникновения процесса горения характерно наличие критических условий (по составу смеси, давлению, температуре, геометрическим размерам системы) возникновения и распространения пламени.
Для горения характерны три типичные стадии: возникновение, распространение b погашение пламени.
В зависимости от состояния горючего и окислителя различают три вида горения:
Гомогенное горение газов в среде газообразного окислителя;
Гетерогенное горение жидких b твердых горючих веществ в среде газообразного окислителя;
Горение взрывчатых веществ.
Окислителем является кислород воздуха. Окислителями могут быть фтор, бром, сера, которые при нагревании разлагаются с выделением кислорода.
Вспышка – быстрое сгорание смеси газов с воздухом, которое может возникнуть от соприкосновения смеси с пламенем, искрой, без перехода в горение. На вспышке горение прекращается, так как успевают сгореть только пары.
Воспламенение – это процесс, при котором вещество нагревается до температуры кипения и горит, пока происходит выделение летучих углеводородов.
Самовоспламенение – процесс, когда вещество нагревается от постороннего источника теплоты, постоянно переходя в самонагревание.
Самовозгорание – процесс самонагрева и последующего возгорания вещества без воздействия открытого источника зажигания. Чем ниже температура, при которой происходит процесс самовозгорания, тем вещество более опасно. Процесс самовозгорания может начаться уже при температуре 10‑20 оС.
Самовозгорающиеся вещества делятся на три группы: самовозгорающиеся от воздействия воздуха (растительные масла), вызывающие горение при воздействии на них воды (карбид кальция), самовозгорающиеся при взаимодействии с другими веществами (при контакте веществ).
Пожаро– и взрывоопасность газов характеризуется следующими показателями: концентрационными пределами распространения пламени, минимальной энергией зажигания, температурой горения и скоростью распространения пламени.
Горение бывает двух видов: полное и неполное.
Полное горение происходит при избыточном количестве кислорода и сопровождается образованием паров воды и диоксида углерода.
Неполное горение очень опасно, так как происходит при недостатке кислорода, при этом образуется токсичный оксид углерода.
Два режима горения: первый режим, в котором горючее вещество образует однородную смесь с воздухом до начала горения, второй режим, в котором горючее вещество и окислитель первоначально разделены, а горение протекает в области их перемешивания (диффузионное горение).
Тепловой поток, который поступает из зоны горения к твердому горючему, зависит от энергии, которая выделяется в процессе горения и от условий теплообмена между зоной горения и поверхностью твердого горючего. В этих условиях режим и скорость горения могут зависеть от физического состояния горючего вещества, его распределения в пространстве и характеристик окружающей среды.
В зависимости от скорости распространения пламени горение может происходить в форме дефлаграционного горения, взрыва и детонации.
Взрыв – процесс быстрого выделения большого количества энергии. В результате взрыва взрывоопасная смесь превращается в сильно нагретый газ с высоким давлением, который с большой силой воздействует на окружающую среду и вызывает образование взрывной волны.
Разрушения, вызванные взрывом, обусловлены действием взрывной волны. По мере удаления от места взрыва механическое воздействие взрывной волны ослабевает.
Скорость распространения пламени при взрыве достигает сотен метров в секунду. При ускорении распространения пламени усиливается сжатие несгоревшего газа, оно распространяется по несгоревшему газу в виде последовательных ударных волн, которые соединяются в одну мощную ударную волну сильно сжатого и разогретого газа. В результате возникает устойчивый режим распространения реакции. Разновидность горения, распространяющегося со скоростью, превышающей скорость звука, называют детонацией . Она характеризуется резким скачком давления в месте взрыва, который обладает большим разрушающим действием.
Жидкости и твердые вещества образуют воспламеняющиеся смеси при повышении их до температуры, при которой вследствие испарения в достаточном количестве образуются газообразные продукты. Взрывоопасными являются смеси пыли с воздухом. Витающая в воздухе пыль может находиться во взвешенном состоянии и оседать на стенах, оборудовании.
При горении выделяются ядовитые газы : синильная кислота, фосген и другие, а содержание кислорода в воздухе падает. Вот почему опасен не только и даже не столько огонь, сколько дым и гарь от него. Надо учитывать и возможные реакции организма человека при увеличении концентрации продуктов горения:
угарного газа : 0,01% - слабые головные боли; 0,05% - головокружение; 0,1% - обморок; 0,2% - кома, быстрая смерть; 0,5% - мгновенная смерть;
углекислого газа : до 0,5% - не воздействует; от 0,5 до 7% - учащение сердечного ритма, начало паралича дыхательных центров; свыше 10% - паралич дыхательных центров и смерть.
ТРЕБОВАНИЯ БЕЗОПАСНОЙ ЭКСПЛУАТАЦИИ БЫТОВЫХ ГАЗОВЫХ ПРИБОРОВ (И ГАЗОВЫХ ПЛИТ В ЧАСТНОСТИ)
Нормы оснащения помещений ручными огнетушителями
Таблица 1
|
2 |
Класс пожара |
Пенные и водные огнетушители вместимостью 10 л |
Порошковые огнетушители вместимостью, л / массой огнетушащего вещества, кг |
Хладоновые огнетушители вместимостью 2 (3) л |
Углекислотные огнетушители вместимостью, л / массой огнетушащего вещества, кг |
||||
|
5 (8)/3(5) |
|||||||||
|
А, Б, В (горючие газы и жидкости) | |||||||||
|
Общественные здания | |||||||||
Примечания :
1. Для тушения пожаров различных классов порошковые огнетушители должны иметь соответствующие заряды: для класса А - порошок ABC (Е); для классов В, С и Е - ВС (Е) или ABC (Е), для класса D - D.
2. Для порошковых огнетушителей и углекислотных огнетушителей приведена двойная маркировка: старая маркировка по вместимости корпуса, л/новая маркировка по массе огнетушащего состава, кг. При оснащении помещений порошковыми и углекислотными огнетушителями допускается использовать огнетушители как со старой, так и с новой маркировкой.
3. Знаком " + + " обозначены рекомендуемые к оснащению объектов огнетушители, знаком " + " - огнетушители, применение которых допускается при отсутствии рекомендуемых и при соответствующем обосновании; знаком " - " - огнетушители, которые не допускаются для оснащения данных объектов.
4. В замкнутых помещениях объемом не более 50 м 3 для тушения пожаров вместо переносных огнетушителей или дополнительно к ним могут быть использованы огнетушители самосрабатывающие порошковые.
Нормы оснащения помещений передвижными огнетушителями
Таблица 2
|
Предельная защищаемая площадь, м 2 |
Класс пожара |
Воздушно-пенные огнетушители вместимостью 100 л |
Комбинированные огнетушители вместимостью (пена, порошок) 100 л |
Порошковые огнетушители вместимостью 100 л |
Углекислотные огнетушители вместимостью, л |
||
|
А, Б, В (горючие газы и жидкости) | |||||||
|
В (кроме горючих газов и жидкостей), Г | |||||||
Примечания:
1. Для тушения очагов пожаров различных классов порошковые и комбинированные огнетушители должны иметь соответствующие заряды: для класса А - порошок АВС (Е); для класса В, С и Е - ВС (Е) или АВС (Е); для класса D - D.
2. Значения знаков " + +", " + " и " - " приведены в примечании 2 к таблице 1.
Оригинальный документ ?
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ ГОРЕНИЯ
Химические процессы при горении. Природа горючих веществ. Лекция 3
Пожаровзрывоопасностъ веществ и материалов - это совокупность свойств, характеризующих их способность к возникновению и распространению горения.
Следствием горения в зависимости от его скорости и условий протекания может быть пожар или взрыв.
Пожаровзрывоопасность веществ и материалов характеризуется показателями, выбор которых зависит от агрегатного состояния вещества (материала) и условий его применения.
При определении пожаровзрывоопасности веществ и материалов различают следующие агрегатные состояния:
газы - вещества, давление насыщенных паров которых при нормальных условиях (25°С и 101325 Па) превышает 101325 Па;
жидкости - вещества, давление насыщенных паров которых при нормальных условиях (25°С и 101325 Па) меньше 101325 Па. К жидкостям относятся также твердые плавящиеся вещества, температура плавления или каплепадения которых ниже 50°С ;
твердые вещества и материалы - индивидуальные вещества и их смесовые композиции с температурой плавления каплепадения выше 50°С , а также вещества, не имеющие температуру плавления (например, древесина, ткани, торф;
пыли - диспергированные вещества и материалы с размером частиц менее 850 мкм.
Горение как химическая реакция окисления веществ с участием кислорода
Горение - один из первых сложных физико-химических процессов, с которым человек встретился еще на заре своего развития. Процесс, овладев которым, он получил огромное превосходство над окружающими его живыми существами и силами природы.
Горение - одна из форм получения и преобразования энергии, основа многих технологических процессов производства. Поэтому человек постоянно изучает и познает процессы горения.
История науки о горении начинается с открытия М.В. Ломоносова: "Горение есть соединение вещества с воздухом". Это открытие послужило основанием для открытия закона сохранения массы веществ пр и их физических и химических превращениях. Лавуазье уточнил определение процесса горения "Горение есть соединение вещества не с воздухом, а с кислородом воздуха".
В дальнейшем существенный вклад в изучение и развитие науки горении внесли советские и российские ученые А.В. Михельсон , Н.Н. Семенов, Я.В. Зельдовия , Ю.Б. Харитон, И.В. Блинов и др.
В основе процесса горения лежат экзотермические окислительно-восстановительные реакции, которые подчиняются законам химической кинетики, химической термодинамики и другим фундаментальным законам (закону сохранения массы, энергии и т.д.).
Горением называется сложный физико-химический процесс, при котором горючие вещества и материалы под воздействием высоких температур вступают в химическое взаимодействие с окислителем (кислородом воздуха), превращаясь в продукты горения, и который сопровождается интенсивным выделением тепла и световым свечением.
В основе процесса горения лежит химическая реакция окисления, т.е. соединения исходных горючих веществ с кислородом. В уравнениях химических реакций горения учитывают и азот, который содержится в воздухе, хотя в реакциях горения не участвует. Состав воздуха условно принимают постоянным , содержащим 21 % по объему кислорода и 79 % азота (в весовых соответственно 23 % и 77 % азота), т.е. на 1 объем кислорода приходится 3.76 объема азота. Или на 1 моль кислорода приходится 3.76 моль азота. Тогда, например, реакцию горения метана в воздухе можно записать так:
СН 4 + 2О 2 + 2 ´ 3.76 N 2 = СО 2 + 2Н 2 О + 2 ´ 3.76 N 2
Азот в уравнениях химических реакций учитывать необходимо потому, что он поглощает часть тепла, выделяемого в результате реакций горения, и входит в состав продуктов горения - дымовых газов.
Рассмотрим процессы окисления.
Окисление водорода осуществляется по реакции:
Н 2 + 0.5О 2 = Н 2 О.
Экспериментальные данные о реакции между водородом и кислородом многочисленны и разнообразны. В любом реальном (высокотемпературном) пламени в смеси водорода и кислорода, возможно образование радикала * ОН или атомов водорода Н и кислорода О , которые инициируют окисление водорода до паров воды.
Горение углерода . Углерод, образующийся в пламенах , может быть газообразным, жидким или твердым. Его окисление независимо от агрегатного состояния происходит за счет взаимодействия с кислородом. Горение может быть полным или неполным, что определяется содержанием кислорода:
С + О 2 = СО 2 (полное) 2С + О 2 = 2СО (неполное)
Гомогенный механизм не исследован (углерод в газообразном состоянии). Взаимодействие углерода в твердом состоянии наиболее изучено. Этот процесс схематически можно представить из следующих этапов:
1. доставка окислителя (О 2 ) к поверхности раздела фаз путем молекулярной и конвективной диффузии;
2. физическая адсорбция молекул окислителя;
3. взаимодействие адсорбированного окислителя с поверхностными атомами углерода и образование продуктов реакции;
4.десорбция продуктов реакции в газовую фазу.
Горение окиси углерода . Суммарная реакция горения окиси углерода запишется СО + 0.5О 2 = СО 2 , хотя окисление монооксида углерода имеет более сложный механизм Основные закономерности горения окиси углерода можно объяснить на основании механизма горения водорода, включая в него реакции взаимодействия окиси углерода с образующимся в системе гидрооксидом и атомным кислородом, т.е. процесс этот многостадийный:
* ОН + СО = СО 2 + Н;О + СО = СО 2
Прямая реакция СО + О 2 -> СО 2 маловероятна, так как реальные сухие смеси СО и О 2 характеризуются чрезвычайно низкими скоростями горения или не могут воспламениться вообще.
Окисление простейших углеводородо в. Метан горит с образованием диоксида углерода и паров воды:
СН 4 + О 2 = СО 2 + 2Н 2 О.
Но этот процесс на самом деле включает в себя целый ряд реакций, в которых участвуют молекулярные частицы с высокой химической активностью (атомы и свободные радикалы): * СН 3 , * Н, * ОН. Хотя эти атомы и радикалы существуют в пламени короткое время, они обеспечивают быстрый расход горючего. В процессе горения природного газа возникают комплексы углерода, водорода и кислорода, а также комплексы углерода и кислорода, при разрушении которых образуются СО, СО 2 , Н 2 О. Предположительно схему горения метана можно записать так:
СН 4 → С 2 Н 4 →С 2 Н 2 →углеродистые продукты+О 2 → C x U y O z → CO , СО 2 ,Н 2 О.
Термическое разложение, пиролиз твердых веществ
При повышении температуры твердого горючего материала происходит разрыв химических связей с образованием более простых компонентов (твердых, жидких, газообразных). Этот процесс называется термическим разложением или пиролизом . Термическое разложение молекул органических соединений происходит в пламени, т.е. при повышенных температурах вблизи поверхности горения. Закономерности разложения зависят не только от горючего, но и от температуры пиролиза, скорости ее изменения, размеров образца, его формы, степени распада и т.д.
Рассмотрим процесс пиролиза на примере наиболее распространенного твердого горючего материала - древесины.
Древесина представляет собой смесь большого количества веществ различного строения и свойств. Основными ее компонентами являются гемицеллюлоза (25 %), целлюлоза (50 %), лигнин (25 %). Гемицеллюлоза состоит из смеси пентазанов (С 5 Н 8 О 4), гексазанов (С 6 Н 10 О 5), полиуронидов . Лигнин имеет ароматическую природу и содержит связанные с ароматическими кольцами углеводы. В среднем древесина содержит 50 % С , 6 % Н, 44 % О. Это пористый материал, объем пор в котором достигает 50 - 75 %. Наименее термостойким компонентом древесины является гемицеллюлоза (220 - 250°С), наиболее термостойким компонентом - лигнин (интенсивное его разложение наблюдается при температуре 350 - 450°С). Итак, разложение древесины состоит из следующих процессов:
| № пп | Температура,°С | Характеристика процессов |
| до 120 - 150 | сушка, удаление физически связанной воды |
|
| 150 - 180 | Разложение наименее стойких компонентов (лумино-вых кислот) с выделением СО 2 , Н 2 О |
|
| 250 - 300 | пиролиз древесины с выделением СО, СН 4 , Н 2 , СО 2 , Н 2 О и т.д.; образующаяся смесь способна воспламеняться от источника зажигания |
| 350 - 450 | Интенсивный пиролиз с выделением основной массы горючих веществ (до 40 % от всей массы); газообразная смесь состоит из 25 % Н 2 и 40 % предельных и ненасыщенных углеводородов; обеспечивается максимальная поставка летучих компонентов в зону пламени; процесс на этой стадии экзотермический; количество тепла, которое выделяется, достигает 5 - 6 % от низшей теплоты сгорания Q ≈ 15000 кДж/кг |
|
| 500 - 550 | Скорость термического разложения резко снижается; выход летучих компонентов прекращается (конец пиролиза); при 600 °С выделение газообразных продуктов прекращается |
Аналогично древесине протекает пиролиз каменного угля, торфа. Однако выход летучих у них наблюдается при других температурах. Каменный уголь состоит их более твердых термостойких углеродсодержащих компонентов, и разложение его протекает менее интенсивно и при более высоких температурах (рис.1).
Горение металлов
По характеру горения металлы делятся на две группы: летучие и нелетучие. Летучие металлы имеют Т пл . < 1000 K и Т кип . < 1500 K . К ним относятся щелочные металлы (литий, натрий, калий) и щелочноземельные (магний, кальций). Горение металлов осуществляется следующим образом: 4 Li + О 2 = 2 Li 2 O . Нелетучие металлы имеют Т пл . > 1000 K и Т кип . > 2500 K .
Механизм горения во многом определяется свойствами оксида металла. Температура летучих металлов ниже температуры плавления их оксидов. При этом последние представляют собой достаточно пористые образования. При поднесении искры зажигания к поверхности металла происходит его испарение и окисление.
При достижении концентрации паров, равной нижнему концентрационному пределу воспламенения, происходит их воспламенение. Зона диффузионного горения устанавливается у поверхности, большая доля тепла передается металлу, и он нагревается до температуры кипения.
Образующиеся пары, свободно диффундируя через пористую оксидную пленку, поступают в зону горения. Кипение металла вызывает периодическое разрушение оксидной пленки, что интенсифицирует горение. Продукты горения (оксиды металлов) диффундируют не только к поверхности металла, способствуя образованию корки оксида металла, но и в окружающее пространство, где, конденсируясь, образуют твердые частицы в виде белого дыма. Образование белого плотного дыма является визуальным признаком горения летучих металлов.
У нелетучих металлов, обладающих высокими температурами фазового перехода, при горении на поверхности образуется весьма плотная оксидная пленка, которая хорошо сцепляется с поверхностью металла. В результате этого скорость диффузии паров металла через пленку резко снижается и крупные частицы, например, алюминия или бериллия, гореть не способны. Как правило, пожары таких металлов имеют место в том случае, когда они вводятся в виде стружки, порошков, аэрозолей. Их горение происходит без образования плотного дыма. Образование плотной оксидной пленки на поверхности металла приводит к взрыву частицы. Это явление особенно, часто наблюдающееся при движении частицы в высокотемпературной окислительной среде, связывают с накоплением паров металлов под оксидной пленкой с последующим внезапным ее взрывом. Это естественно приводит к резкой интенсификации горения.
Горение пылей
Пыль - это дисперсная система, состоящая из газообразной дисперсной среды (воздух) и твердой фазы (мука, сахар, древесина, уголь и т.д.).
Распространение пламени по пыли происходит за счет прогрева холодной смеси лучистым потоком от фронта пламени. Твердые частицы, поглощая тепло от лучистого потока, нагреваются, разлагаются с выделением горючих продуктов, которые образуют горючие смеси с воздухом.
Аэрозоль, имеющая очень мелкие частицы, при воспламенении быстро сгорает в зоне воздействия источника зажигания. Однако толщина зоны пламени настолько мала, что интенсивность его излучения оказывается недостаточной для разложения частиц, и стационарного распространения пламени по таким частицам не происходит.
Аэрозоль, содержащая крупные частицы, также неспособна к стационарному горению. С увеличением размера частиц снижается удельная поверхность теплообмена, и возрастает время их прогрева до температуры разложения.
Если время образования горючей паровоздушной смеси перед фронтом пламени за счет разложения частичек твердого материала больше времени существования фронта пламени, то горение происходить не будет.
Факторы, влияющие на скорость распространения пламени по пылевоздушным смесям:
1. концентрация пыли (максимальная скорость распространения пламени имеет место для смесей несколько выше стехиометрического состава, например, для торфяной пыли при концентрации 1 - 1.5 кг/м 3);
2.зольность (при увеличении зольности уменьшается концентрация горючего компонента и уменьшается скорость распространения пламени);
Классификация пыли по взрывопожарной опасности:
I класс - наиболее взрывоопасная пыль (концентрация до 15 г/м 3);
II класс - взрывоопасная до 15-65 г/м 3
III класс - наиболее пожароопасная > 65 г/м 3 Т св ≤ 250°С;
IV класс - пожароопасная > 65 г/м 3 Т св > 250°С.
Бескислородное горение
Существует ряд веществ, которые при повышении их температуры выше определенного уровня претерпевают химическое разложение, приводящее к свечению газа, едва отличимому от пламени. Пороха и некоторые синтетические материалы могут гореть без доступа воздуха или в нейтральной среде (в чистом азоте).
Горение целлюлозы (звено - С 6 Н 7 О 2 (ОН) 3 - ) можно представить в виде внутренней окислительно-восстановительной реакции в молекуле, содержащей атомы кислорода, которые могут реагировать с углеродом и водородом целлюлозного звена.
Пожар, в котором участвует нитрат аммония, может поддерживаться без подвода кислорода. Эти пожары вероятны при большом содержании нитрата аммония (около 2000 т) в присутствии органического вещества, в частности, бумажных пакетов или упаковочных мешков.
В качестве примера можно привести аварию в 1947 г. Судно “ Grandcamp ” назодилось в порту Техас-Сити с грузом около 2800 т нитрата аммония. Пожар возник в грузовом отсеке с нитратом аммония, упакованном в бумажные мешки. Капитан судна принял решение не гасить огонь водой, чтобы не испортить груз, и пытался ликвидировать пожар, задраив палубные люки и впуская пар в грузовой отсек. Такие меры способствуют ухудшению ситуации, усиливая пожар без доступа воздуха, поскольку происходит подогрев нитрата аммония. Пожар начался в 8 часов утра, а в 9 час. 15 мин.п роизошел взрыв. В результате погибло более 200 человек, столпившихся в порту и наблюдавших за пожаром, в том числе команда судна и экипаж двух самолетов из 4 человек, облетавших судно.
В 13 час 10 мин следующего дня на другом судне, транспортировавшем нитрат аммония и серу, которое загорелось от первого судна накануне, также произошел взрыв.
Маршалл описывает пожар, возникший вблизи Франкфурта в 1961 г. Самопроизвольное термическое разложение, вызванное лентой транспортера, привело к загоранию 8.. т удобрений, треть этого количества составлял нитрат аммония, а остальное - инертные вещества, используемые в качестве удобрений. Пожар продолжался 12 часов. В результате пожара выделялось большое количество ядовитых газов, в состав которых входил азот.
В данной главе приведены основные аспекты, касающиеся понятий, терминов и определений, применяемых в теории горения и взрыва. Также рассмотрены вопросы, связанные с условиями возникновения и развития процессов горения, и ставится акцент на плавном подведении обучающихся к основам теплового и цепного механизмов воспламенения и горения.
Рассматриваются особенности турбулентного и гетерогенного типов горений и образование диффузионных пламен при этих процессах.
Изучаются формы и особенности диффузионных пламен, их излучательная способность, температура пламени, электрофизические свойства и электропроводность пламени.
Особое внимание в данной главе уделено вопросам пи- роза органических и неорганических соединений в пламени, так как эти вопросы, но мнению авторов учебного пособия, имеют важное значение в современных условиях, когда в результате пожара различной сложности при пиролизе образуется ряд токсичных продуктов и синтезируются высокотоксичные соединения, пагубно влияющие на окружающую среду обитания и на человека. Рассмотрены и прикладные вопросы, связанные с теплотворной способностью горючих, их полнотой сгорания и скоростью горения.
В результате изучения данной главы обучающиеся должны знать:
- а) что понимается под терминами горения и взрыва;
- б) в чем заключается физика и химия горения;
- в) обязательные условия возникновения горения и взрыва;
- г) классификацию видов и типов горения;
- д) отличительные особенности тепловой и цепной теорий воспламенения;
- е) отличительные особенности турбулентного, нормального и гетерогенного горений;
- ж) условия перехода горений в кинетический режим и диффузионную область;
- з) особенности горения частиц в зависимости от их размеров;
- и) излучательные свойства пламен, их температурные диапозоны, электрофизические свойства пламен и их электропроводность;
- к) особенности пиролиза органических и неорганических соединений в пламенах;
- л) разложение органических и неорганических соединений и превращения при разложении;
- м) теплотворные способности горючих, их полноту сгорания, а также скорости их горения;
- а) использовать полученные знания при дальнейшем знакомстве с материалом, изложенном в учебном пособии;
- б) использовать полученные знания при моделировании и прогнозировании опасных процессов в техносфере;
- в) решат!) практические задачи, связанные с горением газов, жидких и твердых горючих систем;
- а) методологическими основами механизмов возникновения горения как сложного физико-химического процесса;
- б) основами механизмов и процессов, влияющих на пиролиз и разложение органических и неорганических соединений в пламенах.
Основные понятия и определения, применяемые в теории горения и взрыва
Процессам горения посвящены многочисленные работы отечественных и зарубежных ученых, исследователей и инженеров. Основоположником современной общепринятой тепловой модели горения является наш соотечественник В. А. Михельсон. Η. Н. Семёнов предложил теорию разветвленных цепных реакций, которая послужила основой научных положений о механизме горения. Широко известны работы Н. Н. Семёнова, В. Н. Кондратьева, Η. М. Эмануэля в области кинетики химических реакций. Я. Б. Зельдовичем и Д. Л. Франк-Каменецким рассмотрены основные теоретические вопросы горения. А. С. Предводителевым и другимн исследователями созданы современные представления о горении углерода. Большой вклад в изучение механизма и закономерностей горения конденсированных систем внесли А. Ф. Беляев, К. К. Андреев, Π. Ф. Похил, О. И. Лейпунский и др.
Под горением понимают быстрый физико-химический окислительно-восстановительный процесс с выделением тепла , способный к самораспространению и часто сопровождающийся свечением и образованием пламени. Классические примеры горения связаны с реакциями окисления органических веществ или углерода кислородом воздуха: горение каменного угля, нефти, дров и т.п.
Процесс горения является сложным и состоит из многих связанных между собой отдельных процессов, как физических, так и химических. Физика горения сводится к процессам тепломассообмена и переноса в реагирующей системе. Химия горения заключается в протекании окислительно- восстановительных реакций, состоящих обычно из целого ряда элементарных актов и связанных с переходом электронов от одних веществ к другим – от восстановителя к окислителю.
Окислительно-восстановительные реакции горения могут быть межмолекулярными и внутримолекулярными. Межмолекулярные реакции протекают с изменением степени окисления атомов в разных молекулах. Внутримолекулярные реакции горения протекают с изменением степени окисления разных атомов в одной и той же молекуле (обычно это реакции термического разложения веществ).
Горение – относительно быстрый процесс. Поэтому к горению относят не все окислительно-восстановительные реакции. Медленные реакции (низкотемпературное окисление, биохимическое окисление) и слишком быстрые (взрывчатое превращение) не входят в понятие горения. Горение обусловливают реакции, время протекания которых обычно измеряется секундами или, чаще, долями секунд.
Горение сопровождается выделением тепла. Поэтому к горению приводят не любые относительно быстро протекающие реакции, а те, которые в совокупности являются экзотермическими. Реакции, идущие с затратой тепла извне, не относятся к горению. Горение – самоподдерживающийся за счет выделения энергии процесс. Поэтому горение обусловливают не любые экзотермические реакции, а лишь те, суммарная теплота которых достаточна для того, чтобы процесс стал способным к самораспространению. На практике используют реакции горения, теплота которых, кроме того, достаточна для получения того или иного полезного эффекта.
С учетом изложенного, в понятие горения в широком смысле можно включить самые разнообразные химические реакции между элементами и их соединениями, включая реакции распада соединений. Горение происходит не только за счет образования оксидов, но также за счет образования фторидов, хлоридов и нитридов. Известно горение при образовании боридов, карбидов и силицидов ряда металлов. Выделение тепла и развитие процесса горения могут также происходить при образовании сульфидов и фосфидов некоторых элементов. Все это свидетельствует о разнообразии возможных реагентов, участвующих в горении, и химических процессов между ними.
Энергия, выделяющаяся при горении в результате протекания химических реакций, расходуется на поддержание процесса горения, создание эффекта, а также рассеивается в окружающее пространство. Стационарное горение наступает при равенстве теплоприхода и теплорасхода на подготовку к горению очередных порций вещества.
В процессе горения, так же как и в других химических процессах, обязательны два этапа: создание молекулярного контакта между реагентами и само взаимодействие молекул с образованием продуктов реакции. Скорость превращения исходных продуктов в конечные зависит от скорости смешивания реагентов путем молекулярной и турбулентной диффузии и от скорости химических реакций. В предельном случае характеристики горения могут определяться только скоростью химического взаимодействия, т.е. кинетическими константами и факторами, влияющими на них (кинетический режим горения), или только скоростью диффузии и факторами, влияющими на нее (диффузионный режим горения).
Вещества, участвующие в горении, могут быть в газообразном, жидком (или загущенном) и твердом состояниях, предварительно перемешаны между собой или не перемешаны. Если в горючей системе отсутствуют поверхности раздела между реагентами, то такую систему называют гомогенной, если имеются поверхности раздела, систему называют гетерогенной.
Горение часто сопровождается свечением продуктов сгорания и образованием пламени. Под пламенем понимают газообразную среду, в ряде случаев включающую диспергированные конденсированные продукты, в которой происходят физико-химические превращения реагентов. Для газообразных систем весь процесс горения протекает в пламени, поэтому часто понятия "горение" и "пламя" используют как синонимы. При горении конденсированных систем часть физико-химических превращений (нагревание, плавление, испарение, начальное разложение и взаимодействие реагентов) может происходить вне пламени непосредственно в исходном образце и на его поверхности. Известно беспламенное горение, когда процесс протекает только в конденсированной системе практически без газообразования и диспергирования (горение некоторых термитов и смесей металлов с неметаллами). Пламя или часть его, как правило, характеризуется видимым излучением, хотя известны и прозрачные пламена. Наиболее высокотемпературную часть пламени обычно называют основной реакционной зоной, поверхностью пламени или фронтом пламени.
После инициирования процесса горения в какой-либо части объема реагентов процесс распространяется по всему объему. В отличие от взрыва процесс горения распространяется в реагирующей среде со скоростью, не превышающей скорость звука.
Если реагенты перед началом горения небыли перемешаны, то горение и пламя называют диффузионными, так как смешение горючего с окислителем достигается путем диффузии. Простейшими примерами являются пламя обычной свечи и пламена, образующиеся при смешении двух газообразных потоков реагентов, один из которых окислитель, а другой – горючее.
Если же реагенты предварительно перемешаны (гомогенная смесь), процесс горения называют горением предварительно перемешанных смесей, или гомогенным горением, а образующееся пламя – предварительно перемешанным. Примерами могут служить горение смесей водорода, оксида углерода и углеводородов с кислородом или воздухом. Надо учесть, однако, что в технике при горении не всегда выполняется условие полного предварительного перемешивания реагентов и возможны переходные между гомогенным и диффузионным режимы горения.
Гетерогенное горение происходит на поверхности раздела фаз. Одно из реагирующих веществ находится в конденсированной фазе, другое (обычно кислород) доставляется посредством диффузии из газовой фазы. При этом конденсированная фаза должна иметь высокую температуру кипения, чтобы при температуре горения практически не происходило ее испарения. Примерами гетерогенного горения служат горение угля, нелетучих металлов. В зависимости от характера течения газового потока, образующего пламя, различают ламинарные и турбулентные пламена. В ламинарных пламенах течение ламинарное, или слоистое, все процессы массообмена и переноса происходят путем молекулярной диффузии и конвекции. В турбулентных пламенах течение турбулентное, процессы массообмена и переноса осуществляются за счет не только молекулярной, но и турбулентной диффузии (в результате макроскопического вихревого движения). Характеристики горения разнообразны. Их можно подразделить на следующие группы: 1) форма, размер и структура пламен; 2) излучение, температура пламени и ионизация продуктов горения; 3) тепловыделение и полнота сгорания; 4) скорость горения и пределы устойчивого горения. Характеристики горения могут изменяться в широких пределах в зависимости от свойств горючей системы и условий горения.
Известны следующие виды горения: горение газообразных жидких и твердых веществ и их смесей за счет взаимодействия с окружающей газообразной средой или с потоком этой среды; горение соединений за счет экзотермического распада и горение твердых гомогенных топлив за счет внутримолекулярного окисления.
Для создания максимальных эффектов: реактивной тяги, ионизации продуктов сгорания (плазмы), видимого и селективного излучения, воздействия на материалы и состояние атмосферы – в практике применяют разнообразные рецептуры смесей реагентов. Такими смесями являются порох, твердые и жидкие ракетные топлива, различные по назначению пиротехнические составы и термитные смеси.
Вещества, используемые в качестве горючего, многочисленны. Однако, по нашему мнению, многие закономерности горения могут быть описаны и выявлены при рассмотрении горения водорода, оксида углерода, углерода, простейших углеводородов и нескольких высокотеплотворных металлов в различных активных средах. Другие вещества разлагаются или газифицируются на первоначальных стадиях горения в основном с образованием перечисленных выше продуктов.
При горении происходят разнообразные сложные химические процессы:
- 1) разложение исходных соединений (углеводородов, элементоорганических соединений, нитросоединений, неорганических окислителей);
- 2) превращение продуктов разложения (образование углерода в пламени, реакции метана и водяного газа);
- 3) окисление (водорода, оксида углерода, углерода, простейших углеводородов, металлических горючих) и образование конденсированных оксидов металлического горючего;
- 4) диссоциация продуктов сгорания;
- 5) ионизация продуктов сгорания.
Взрывом принято называть крайне быстрое выделение большого количества энергии, связанное с внезапным изменением состояния вещества, сопровождаемое разрушением и разбрасыванием окружающей среды, возникновением и распространением в ней так называемой ударной волны.
Для взрыва характерны три обязательных условия (фактора):
- 1) экзотермичность реакции;
- 2) высокая скорость протекания реакции (время реакции составляет 10-4–10-7 с);
- 3) большое давление газообразных продуктов, которые в процессе расширения совершают механическую работу.
С первого взгляда определение настолько просто и понятно, что кажется даже малосодержательным. Однако при более внимательном подходе оказывается, что в нем простота и ясность сочетаются с глубоким анализом явления взрыва.
Прежде всего выясним, что значит "очень быстрое" выделение энергии. Быстрота тех или иных явлений – понятие относительное. Следовательно, очень быстрое выделение энергии взрыва должно сравниваться с другими видами выделения или преобразования энергии.
Таким образом, выделение энергии при взрыве является существенно более быстрым, чем другие формы выделения энергии в сходных условиях. Например, выделение энергии при взрыве происходит значительно быстрее, чем выделение энергии при горении. Наиболее важным при взрыве является то, что энергия выделяется в пределах заряда взрывчатого вещества быстрее, чем она потом передается окружающей среде.
Что означает "большое количество" энергии? Это определение надо рассматривать, сравнивая энергию взрыва с той энергией, которая, так или иначе, содержится в среде, окружающей место взрыва. В этом определении важно то, что выделяющаяся при взрыве энергия намного больше энергии, содержащейся в окружающей среде.
Необходимо также уточнить понятие "выделение энергии". Как известно, энергия не может возникать из ничего или исчезать бесследно. Поэтому под выделением энергии понимают превращение в энергию взрыва соответствующего запаса энергии, которая накоплена и находится в скрытой, потенциальной форме в том или ином месте.
До момента взрыва обычного взрывчатого вещества энергия взрыва содержится в скрытой, потенциальной форме в его молекулах, точнее, в электронных оболочках этих молекул. Однако простое выделение энергии еще не означает, что произошел взрыв. Понятие "взрыв" связано с сильным механическим действием, т.е. с появлением механических сил, приложенных к среде и отдельным телам, окружающим место взрыва. Если этого нет, то нет и взрыва.
Чтобы выделившаяся энергия могла осуществить механическое действие, нужно рабочее тело, т.е. вещество, которое могло бы произвести достаточно большое давление на окружающую среду. С этой точки зрения взрыв может рассматриваться как результат работы очень мощного теплового двигателя, действующего в течение весьма малого времени. При этом газы, будучи в начале сильно нагретыми и сжатыми, расширяются и производят механическую работу, перемещая среду, окружающую место взрыва.
Чтобы обеспечить сильное нагревание выделившихся при взрыве 1330В и создать в них высокое давление, необходимо, чтобы энергия либо выделилась в этих газах, либо была передана им до того, пока еще не произошло заметных потерь энергии и заметного увеличения их объема. Это значит, что процесс выделения или передачи энергии должен распространяться со скоростью, заметно превосходящей скорость расширения взрывных газов.
Обычно при взрыве начальная скорость расширения газов достигает около 1 км/с. Скорость распространения процесса взрыва, называемого детонацией, у взрывчатых веществ несколько больше и находится в пределах от 2 до 8 км/с.
При взрыве какого-либо взрывчатого вещества, например тротила, происходит его преобразование в раскаленные взрывные газы, имеющие высокое давление. При этом энергия выделяется первоначально в виде теплоты, заключенной в сильно сжатых газах. Газы действуют на окружающую среду с такой силой, что эта среда начинает сжиматься и перемещаться. Поэтому газы получают возможность расширяться, производя работу подобно газам, движущим поршень двигателя внутреннего сгорания, но с тем отличием, что взрывные газы раздвигают окружающую среду по всем возможным направлениям, а газы двигателя внутреннего сгорания двигают поршень только но оси цилиндра. При расширении газы интенсивно охлаждаются, их давление быстро падает и энергия передается окружающей среде с очень большим коэффициентом полезного действия.
Менее мощные взрывы могут происходить и без выделения энергии в результате каких-либо реакций или ее принесения извне. Причиной этого вида взрывов может быть внезапное разрушение сосуда, содержащего сильно сжатый газ или пар. Примером таких взрывов являются взрывы баллонов со сжатым воздухом или иными газами, взрывы паровых котлов.
Взрывообразный характер имеет разрушение сильно сжатых хрупких тел, сопровождающееся интенсивным разлетом их кусков. Так разрушаются, например, массивные стеклянные шары, сжимаемые гидравлическим прессом.
Взрывом обычно заканчиваются очень сильные удары быстродвижущихся тел о прочные преграды. Такие взрывы происходят при ударе метеорита о поверхность земли.
Следовательно, явление взрыва является по своей природе сложным физико-химическим процессом, протекающим за очень короткий промежуток времени, равный долям миллисекунды, и поэтому существуют определенные сложности в его экспериментальном и научном изучении. Более детально механизмы возникновения взрывчатых превращений и некоторые математические зависимости, описывающие эти закономерности и механизмы возникновения взрыва, будут рассмотрены в главе 4 данного пособия.

 Всеволод большое гнездо как правитель
Всеволод большое гнездо как правитель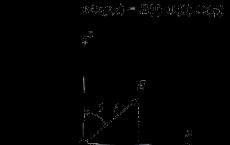 Как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома
Как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома Самые первые спички в мире
Самые первые спички в мире